FORSKNINGSGRUPPEN
Muscle growth and metabolism
- Regulering af muskelanabolisme og katabolisme, med særlig fokus på mTORC1, mTORC2 og AMPK.
- Regulering af GLUT4-translokation og glukoseoptagelse i muskel.
- Identifikation og karakterisering af nye signalproteiner aktiveret af forskellige former for fysisk aktivitet og diæt.
- NOX2- og redoxsignalerings rolle i akut og kronisk træningstilpasning, insulinresistens og anabolsk resistens.
- Kræft-associeret muskeltab (cachexia) og dennes interaktion med insulinvirkning i musklen.
Skeletmuskulatur, der omfatter ~ 40% af den menneskelige kropsmasse, er nødvendig for bevægelse, et vigtigt sted for lagring af makronæringsstoffer og deres stofskifte. Fysisk inaktivitet, for højt energiindtag og aldring påvirker negativt skeletmuskulaturen og vides i stigende grad at dele patofysiologiske fællestræk.
I skeletmuskelfibre, den dominerende celletype i skeletmuskelvæv, er disse faktorer alle forbundet med forstyrret stofskifteregulering (fx insulinresistens) og nedsat vedligeholdelse af muskelmasse/styrke.
Regelmæssig fysisk aktivitet er blandt de mest kraftfulde interventioner til at modvirke muskeldysfunktion. Ud over at forbedre muskelfiberfunktionen stimulerer fysisk aktivitet også gavnlige tilpasninger i andre celletyper i muskelvævet og i hele kroppen gennem frigivelse af para/endokrine signaler i form af myokiner og/eller exosomer fra muskelfibrene og andre celletyper.
Målet med vores forskning er at identificere de molekylære mekanismer, der forårsager muskel dysfunktion i forskellige sammenhænge og at klarlægge hvordan fysisk aktivitet påvirker disse.
Forskningsprojekter
Muskulær insulinresistens - en medvirkende årsag til udviklingen af type 2 diabetes - og tab af muskelmasse er velkendte konsekvenser af fysisk inaktivitet, overvægt og aldring og bidrager til øget sygelighed og dødelighed.
Forskellige former for fysisk aktivitet kan omvendt forbedre musklernes stofskifte og forøge muskelmassen.

En bedre molekylær forståelse af hvad der går galt i muskelsygdom og hvordan fysisk aktivitet modvirker dette er vigtig, ikke kun for vores grundvidenskabelige fysiologiske forståelse, men for udviklingen af fremtidige lægemidler.
Overordnede temaer
1) Hvilken rolle spiller reaktive oxygen arter i muskelcellesignalering?
Reaktive iltholdige molekyler med ekstra uparrede elektroner, på engelsk kaldet Reactive oxygen species (ROS) blev oprindeligt betragtet som skadelige for levende organismer men vides idag at spille en positive rolle som signalmolekyler der styrer cellers funktion.
Vi undersøger hvilken rolle ROS-dannelse i forskellige underområder af muskelceller spiller for dels muskelsygdom og dels for tilpasninger til fysisk aktivitet.
2) Hvordan signalerer kinasen mTOR i muskel?
mTOR er en kinase der påsætter fosfatgrupper på proteiner, en klassisk cellesignaleringsmekanisme. mTOR vides at stimulere cellulær vækst, også i muskel i forbindelse med anabole stimuli.
Vi undersøger herunder hvordan mTOR aktiviteten reguleres i forskellige dele af muskelcellen, hvordan mTOR videregiver signaler, og hvordan mTOR interagerer med AMPK, en kinase som ofte ses at hæmme mTOR aktiviteten.
Dette undersøges ved en kombination af transgene muskelspecifikke knockout/knock-in mus, cellekultur-studier, avanceret lys og elektronmikroskopi, molekylærbiologi og biokemi og forskellige former for proteomics, ofte som del af større nationale og internationale samarbejder.
Derudover samarbejder vi ofte med andre forskningsgrupper i Sektionen for Molekylær Fysiologi og på NEXS omkring analyser af unikt tilgængelige muskelbiopsimateriale for at undersøge relevansen af vores identificerede mekanismer for mennesket.
Finansiering
Min forskning finansieres i perioden 2020-2025 bl.a. af en Ascending Investigator bevilling fra Lundbeckfonden, projektbevillinger fra Novo Nordisk Fonden og det frie forskningsråd – Sundhed og sygdom, og det danske Diabetes akademi.
mTORC1 og AMPK er to centrale intracellulære signalproteiner som styrer henholdsvis vækst og nedbrydning/genbrug af cellen. En koordineret og reciprok regulering af disse proteiner (at slukke for den ene når den anden er aktiv) er kritisk for cellers funktion og er for nyligt foreslået at blive varetaget af proteinerne AXIN1 og AXIN2.
Dette projekt undersøger betydning af AXIN1 og 2 i muskel ved hjælp af transgene mus som specifikt mangler et eller begge proteiner i dette væv.
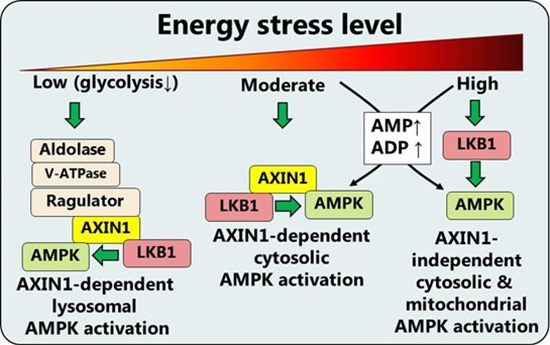
Aktivering af mTORC1 udløser i muskel et anabolt (opbyggende) respons mens aktivering af AMPK udløser et katabolt (nedbrydende) respons. Der vides i mange tilfælde at være en reciprok regulering af mTORC1 og AMPK for at undgå at disse modsatvirkende proteiner aktiveres samtidig og der derved opstår en molekylær signalforvirring.
De to AXIN isoformer er en del af et kompleks som er vist i celler at aktivere AMPK og hæmme mTORC1. AXIN1 og 2's rolle er dog ikke direkte undersøgt og slet ikke i muskel. Vores arbejdshypotese er at mus uden begge AXIN isoformer vil udvise en nedsat evne til at aktivere AMPK og øget aktivering af mTORC1. Sideløbende med undersøgelsen af AXIN isoformernes rolle i muskel udvikles i dette projekt nye metoder til at se på AMPK og mTORC1-signalering i specifikke områder af muskelcellen ved hjælp af biosensorer og avanceret mikroskopi.
En bedre forståelse af hvordan mTORC1 og AMPK aktiviteten koordineres kan føre til nye lægemidler der modvirker muskeltab, men har også betydning for andre tilstande hvor disse proteiner er tilskrevet en rolle, fx kræft og cellulær aldring.
Støttet af
Projektperiode:
Kontakt
Lektor Thomas E. Jensen
Reaktive oxygen arter (eng. Reactive oxygen species - ROS) er i skeletmuskel både foreslået at være gavnlige signalmolekyler som stimulerer tilpasning i den arbejdende muskulatur under og efter arbejde, men også er skadelige i for høje mængder, hvor de kan resultere i præ-diabetisk insulinresistens og tab af muskelmasse.
Dannelsen af reaktive oxygen arter (ROS) beskrives ofte som et skadeligt biprodukt af respiration i cellernes kraftværk, mitochondrier. Der er dog andre kilder til ROS i skeletmuskel, herunder det ROS-dannende enzym NOX2. NOX2 er i tidligere musestudier vist at være en hovedkilde til iltradikaler både under muskelkontraktion i isoleret muskel og i forskellige sygelige tilstande såsom insulinresistens og muskeldystrofi.
I dette projekt fremavler vi den første transgene mus hvor den katalytiske subunit af enzymet NOX2 i skeletmuskel specifikt kan fjernes i fuldt udvoksede mus. Denne musemodel for NOX2 mangel vil i et internationalt samarbejde blive kombineret med ROS biosensorer og kunstig chemogenetisk enzymer, for henholdsvis at måle og manipulere med ROS i forskellige intracellulære områder af muskelfibre og celler, samt redox-proteomics for at identificere nye ROS-afhængige signalveje. Der planlægges også et studie på personer med naturlig NOX2-deficiens.
Disse studier vil forhåbentlig sætte os vi i stand til at udlede betydningen af NOX2 vs. andre ROS-kilders betydning for musklens tilpasningsevne til forskellige forhold, herunder fysisk aktivitet, fedme-associeret insulinresistens og forskellige former for muskelatrofi. Dette vil have bred betydning fra sportspræstationsoptimering til forståelse og muligvis forebyggelse og behandling af forskellige sygdomme såvel i muskel som i andre væv.
Støttet af
Projektperiode:
Kontakt
Postdoc Carlos Olguin
Lektor Thomas E. Jensen
Enzymerne mTORC1 og AMPK organiserer hvordan celler reagerer på eksterne stimuli som hormoner og næringsstoffer. Hvordan mTOR og AMPK koordinerer deres samspil og hvilke proteiner de signalerer til hvor i cellen vides dog ikke i detaljer. Formålet med dette projekt er dels at forstå hvordan mTORC1 og AMPK kommunikerer med hverandre og dels hvordan de i øvrigt orkestrer deres signaltransduktion.
mTORC1 og AMPK er intracellulære signalproteiner som videregiver information i celler og er vist at være centrale regulatorer af cellulær funktion i såvel raske celler som i en række sygdomme. Forståelsen af mekanismerne bag effekterne af AMPK og mTORC1 er dog mangelfuld. Dette gælder også i skeletmuskulaturen hvor AMPK og mTORC1 også er foreslået at være vigtige regulatorer af musklens tilpasningsevne til f.eks. fysisk aktivitet eller forskellige sygdomme.
I dette projekt har vi, i et internationalt samarbejde med forskere fra University of Sydney med ekspertise i massespektrometri, gennemført målinger af tusindvis af nye ændringer på proteiner i musemuskler med kunstigt aktiveret AMPK eller mTORC1. Ved hjælp af såkaldte maskinlærings algoritmer har vi derefter ”trænet” et computerprogram til at forudsige nye AMPK og mTORC1 targets og på denne vis identificeret en lang liste af proteiner der sandsynligvis reguleres af AMPK eller mTORC1.
Vi følger i øjeblikket op på nogle af disse nye proteiner og mekanismer i cellekultur, mus og humant muskelbiopsimateriale.
Støttet af
Projektperiode:
Kontakt
Lektor Thomas E. Jensen
Hvis en typisk celle var på størrelse med København så ville et typisk protein være ca. på størrelse med et menneske. Det siger sig selv at lokalitet, hvor proteinerne opholder sig, derfor er en vigtig parameter når man vil forstå deres funktion. I dette projekt undersøges ved hjælp af avanceret mikroskopi hvor proteiner opholder sig i muskel under forskellige forhold.
At undersøge lokalitet i den tætpakkede skeletmuskel er en udfordring. Her anvender vi i samarbejde med en mikroskopiekspert fra University of Bristol en mikroskopiteknik kaldet korrelativ lys- og elektronmikroskopi (CLEM) i kombination med en ny metode til fremstilling og præservering af muskelsnit. Dette sætter os i stand til at karakterisere hvor meget der er af et givent protein af interesse i forskellige subcellulære områder i muskel under forskellige forhold.
Vi tester blandt andet en formodning om et foregående muskelarbejde øger evnen til at rekruttere glukosetransportør 4 (GLUT4) til muskelfiberoverflademembranen for at øge glukoseoptagelsen i mus og mennesker ved at omfordele GLUT4 inden i cellen i timerne efter arbejde.
Såfremt denne teori holder stik vil det være et konceptuelt nybrud i vores forståelse af hvordan fysisk aktivitet forbigående potentierer insulin's evne til at øge glukoseoptagelsen.
Støttet af
Projektperiode:
Kontakt
Postdoc Jonas R. Knudsen
Lektor Thomas E. Jensen
Det er kendt, at vækst og differentieringsfaktor 15 (GDF15) formindsker fødeindtagelsen i gnavere, og dens koncentration i blodet øges med træning og graviditet, men også med alvorlig sygdom. Dets rolle i kroppen er derfor et mysterium.
Vi har vist i foreløbige undersøgelser, at behandling med GDF15 i 5 dage hos mus dramatisk øger insulinvirkningen i leveren og i musklerne. Dette er et meget spændende fund.
Projektet sigter mod at tydeliggøre de molekylære mekanismer bag denne effekt og også bestemme, om effekten er fremkaldt gennem den kendte receptor for GDF15 (GFRAL), som udelukkende er placeret i hjernen. Dette gøres ved at administrere GDF15 direkte i hjernen såvel som at undersøge, om effekten af GDF15 ophæves hos mus, der ikke har GFRAL-receptoren i hjernen. Endelig, da GDF15 stiger med træning, vil vi afgøre, om denne stigning er vigtig for at øge insulinvirkningen med træning.
Støttet af
Projektperiode:
Kontakt
Professor Erik A. Richter
Transport af glukose fra kapillærerne til interstitiet i muskler anses for at foregå gennem endotheliale porer mellem endothelcellerne.
Imidlertid udtrykker endothelcellerne i muskler en stor mængde GLUT1 transportører og i projektet undersøges det om disse transportører deltager i den transendotheliale glukosetranport.
Dette gøres ved at måle den interstitielle glukosekoncentration ved mikrodialyse i musemuskler under en euglykæmisk hyperinsulinæmisk clamp. Musene er enten kontrolmus eller mus med inducerbar knock out af GLUT1 i endothelcellerne.
Støttet af
Projektperiode:
Kontakt
Professor Erik A. Richter
Fysisk aktivitet øger insulinfølsomheden i de muskler som har udført arbejdet. Alle tidligere undersøgelser i mennesker har brugt den euglykæmiske, hyperinsulinæmiske clamp som model til at måle insulinfølsomheden.
Dette er imidlertid en kunstig laboratoriesituation hvor insulinkoncentrationen hæves ved infusion og glukosekoncentrationen i blodet holdes normal ved glukoseinfusion.
I den normale situation vil man spise kulhydrater efter arbejde og dermed opnå endogen insulinsekretion, forhøjet blodsukker og sekretion af tarmhormoner, en helt anden situation end under en clamp.
Under en clamp har vi vist at den interstitielle glukosekoncentration i musklerne kan blive begrænsende for musklerne glukoseoptagelse, hvilket måske kan skyldes den kunstige undersøgelsessituation.
Formålet med nærværende projekt er at undersøge om øget insulinfølsomhed efter arbejde er støre under måltidstimulation sammenlignet med clamp og om den interstitielle glukosekoncentration er begrænsende for glukoseoptagelsen.
Støttet af
Projektperiode:
Kontakt
Professor Erik A. Richter
PROJEKTET ER AFSLUTTET
Copenhagen Women Study (CWS) var et forskningsinitiativ, der søgte at afdække hvordan fysisk aktivitet og ernæring kan bruges som strategi til forbedring af den mentale og fysiske sundhed hos mennesker, herunder ved forebyggelse, rehabilitering og i behandling af sygdom.
Målet var at danne en tværfaglig forskningsenhed på Københavns Universitet, der med afsæt i velkontrollerede humane studier genererede og formidlede målrettede retningslinjer til individet eller befolkningsgrupper i forhold til fysisk aktivitet og ernæring.
Finansiering
Fysisk aktivitet, ernæring og sundhed var et af 18 forskningsinitiativer opstartet i 2013 baseret på en bevilling fra 'University of Copenhagen Excellence Programme for Interdisciplinary Research (2016)'.
Projektet sluttede ved udgangen af 2017 og det har været overordentligt succesfuldt. Projektet fik en flot midtvejsevaluering i 2016 og blev slutevalueret i foråret 2018.
Slutrapport
Hent slutrapporten Physical activity and nutrition for improvements of health (engelsk).
Kontakt
Professor Erik A. Richter
Medlemmer af forskningsgruppen
| Navn | Titel | Telefon | |
|---|---|---|---|
| Erik A. Richter | Professor | +4535321626 | |
| Jonas Roland Knudsen | Postdoc | ||
| Kaspar Wredstrøm Persson | Ph.d.-stipendiat | +4535320305 | |
| Roberto Andrés Meneses Valdés | Ph.d.-studerende | ||
| Thomas Elbenhardt Jensen | Lektor |

